週二,聯邦監管機構允許緊急使用第一項完全可在家進行的快速冠狀病毒檢測。使用這種檢測30分鐘即可得出結果。
FDA這一宣佈標誌著全國將COVID-19檢測範圍擴大到醫療設施和檢測場所之外的努力邁出重要一步。然而,這項檢測需要處方,因此,它的使用在開始階段會受到限制。
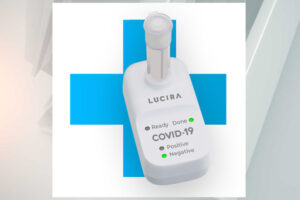
加州製造商Lucira Health獲得FDA對這種一次性使用檢測試劑盒的緊急授權。
在使用公司檢測盒時,用戶可以自己用拭子拭取鼻腔樣本,然後將樣品旋入一小瓶實驗室溶液中,並插入可擕式設備。結果通過為標記為陽性或陰性的燈光顯示。
迄今為止,FDA已批准近300項冠狀病毒檢測。絕大多數檢測需要健康專業人員進行鼻腔拭子,並且必須在實驗室使用高科技設備處理。還有一些檢測可以讓人們在家裡收集鼻腔拭子或唾液,但需要發送到實驗室,而這通常意味著需要等待數天才能得到結果。
據Lucira公司網站,Lucira COVID-19檢測源於該公司為開發家庭流感檢測而進行的研究。疫情爆發後,Lucira利用它的技術開始檢測COVID-19。
FDA說,它還授權Lucira檢測在醫生辦公室和檢測點使用。目前,全國所有檢測點都必須向州和聯邦健康部門報告檢測結果,以追蹤疫情。醫生將被要求報告家庭檢測結果。
FDA監管機構在授權這項新檢測時,行使其在公共健康危機期間迅速加快實驗產品供應速度的緊急權力。在正常情況下,FDA需要安全有效的證據才批准新檢測方法。但在突發公共健康事件中,該機構可以降低這些標準。
FDA聲明沒有透露檢測準確性,也沒有披露監管機構用來做出決定的研究結果。